Гипофиз: источники развития, строение, тканевой и клеточный состав адено- и нейрогипофиза, их функциональная характеристика. Связь гипофиза и гипоталамуса. Медицинская учебная литература Гонадотропины. Регуляция секреции и физиологические эффекты
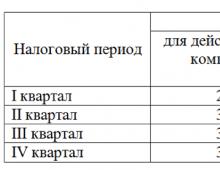
Нейрогипофиз представляет со-бой удлиненное выпячивание вентрального гипоталамуса, непосредственно контакти-рующее с задней и дистальной частью аденогипофиза [I]. У взрослых мужчин и жен-щин масса нейрогипофиза составляет приблизительно 100 мг, и его можно разделить на две части, соединенные короткой ножкой, проходящей сквозь диафрагму турецкого седла. Верхнюю часть называют по-разному: воронкой или срединным возвышением, а нижнюю - инфундибулярным отростком или pars nervosa. Обе части снабжаются кровью из ветвей верхней и нижней гипофизарных артерий, отходящих от задней коммуни-кантной и внутрикавернозной части внутренних сонных артерий. В pars nervosa ар-териолы распадаются на местные капиллярные сети, которые дренируются непосредст-венно в яремную вену через венозные синусы (турецкого седла, кавернозные и боко-вые). В воронке первичные капиллярные сети сливаются в другую си-
Рис. 9-1. Нейрогипофиз и его основные нервные связи.
НГ - нейрогипофиз; АГ - аденогипофиз: ДТС - диафрагма турецкого седла; ПЗН - перекрест зрительных нервов: СОЯ - супраоптическое ядро: ПВЯ - паравентрикулярное ядро ОР - осморецептор; БР - волюм- и барорецептор ЯСТ - ядро солитарного тракта: РЦ - рвотный центр.
стему - воротные вены, которые перед впадением в системную циркуляцию перфузируют аденогипофиз.
Под микроскопом нейрогипофиз выглядит как густо переплетенная сеть капилляров, питуицитов и безмякотных нервных во-лолон, содержащих большое число электронно-плотных гранул. Эти нейросекреторные нейроны берут начало главным образом в крупноклеточных ядрах супраоптической и паравентрикулярной областей гипоталамуса . Большинство аксонов направляется отсюда вентрально и каудально и оканчивается луковицеобразными расширениями на капиллярных сетях, пронизывающих все части нейрогипофиза, в том числе ножку и воронку (рис. 9-1). Последняя служит местом окончания и других нейросекреторных нейронов, влияющих на переднюю долю гипофиза, путем высвобождения стимулирующих или тормозящих факторов в воротные вены. Играют ли аналогичную роль нейрогипофизарные нейроны воронки - неизвестно. Существует и особый еще меньший отдел нейрогипофиза, который проецируется на III и, вероятно, боковые желудочки мозга . По-видимому, из него секрет, выделяется непосредственно в СМЖ, но окончательно его функция не установлена .
Еще по теме АНАТОМИЯ:
- Хирургическая анатомия передней брюшной стенки и топографическая анатомия матки во время беременности. Морфологические изменения миометрия
- Глава 1. Анатомия и гистология (клеточное строение) кожи. Особенности анатомии и гистологии кожи у детей
- Глава 2Клиническая анатомия, физиология и биоценоз женских полових органов.Плод как обьект родов. Акушерская терминология АНАТОМИЯ, ФИЗИОЛОГИЯ И БИОЦЕНОЗ ПОЛОВИХ ОРГАНОВ ЖЕНЩИНЬІ
Билет 6.
1. Почки. Источники и основные этапы развития. Строение и кровоснабжение. Нефроны, их разновидности, основные отделы, гистофизиология. Структурные основы эндокринной функции почек. Возрастные изменения.
Развитие мочевыделительной системы в эмбриогенезе идет в три фазы, при этом последовательно закладываются три парных органа: предпочка, первичная почка и постоянная почка.
Предпочка участвует в закладке мезонефрального протока, первичная участвует в формировании гонад.
Окончательная почка начинает формироваться на 4-5-й неделе эмбрионального развития из двух источников: выроста мезонефрального протока и нефрогенной ткан.
(из анатомии – расположение, макростроение итд)
Граница между корковым и мозговым веществом неровная: участки коркового вещества спускаются в мозговое, формируя почечные колонки (колонки Бертйни), а мозговое вещество проникает в корковое, образуя так называемые мозговые лучи (лучи Феррейна).
Структурно-функциональной единицей почки является нефрон, количество которых в почке достигает 1-2 миллионов. В состав нефрона входят: Корковое вещество содержит все почечные тельца и все извитые части проксимальных и дистальных канальцев. В мозговом веществе и мозговых лучах располагаются прямые канальцы - петля Генле и собирательные трубочки, которые в силу параллельности их хода придают этой зоне исчерченный вид.
Кортикальные нефроны имеют почечное тельце, лежащее в наружной части коркового вещества, и относительно короткую петлю Генле, расположенную в наружной части мозгового вещества.
У юкстамедуллярных нефронов почечное тельце расположено глубоко - на границе с мозговым веществом, а длинная петля Генле проникает в мозговое вещество вплоть до верхушек пирамид.
Кровообращение почки обеспечивает почечная артерия. Войдя в ворота органа, она распадается на междолевые артерии, которые идут радиально между пирамидами и по мозговому веществу до его границы с корковым. Здесь междолевые артерии разветвляются на дуговые артерии, проходящие вдоль этой границы в нижней части почечных колонок. Далее же кровообращение коркового и мозгового вещества обеспечивают разные системы сосудов.
В корковое вещество от дуговых отходят междольковые артерии, разделяющиеся затем на внутридольковые артерии. От последних (либо сразу от междольковых) начинаются приносящие артериолы. Причем от верхних внутридольковых артерий приносящие артериолы направляются к корковым нефронам. а от нижних - к юкста-медуллярным. В почечном тельце приносящая артериола распадается на капилляры, образующие сосудистый клубочек (первичная, «чудесная» сеть капилляров), из которых затем формируется выносящая артериола. В корковых нефронах выносящая артериола по диаметру приблизительно в два раза меньше приносящей. Это создает в капиллярной сети клубочка давление в 50-70 мм рт. ст. Данный факт является важным условием для первой фазы образования мочи -фильтрации жидкой части плазмы из сосудов клубочка в капсулу почечного тельца.
Выносящие артериолы снова распадаются на капилляры, которые оплетают в корковом веществе извитые канальцы нефронов. Из этой вторичной капиллярной сети осуществляется питание тканей органа, а кроме того, в ней идет реабсорбция полезных веществ из просвета извитых канальцев в кровь. Из капилляров перитубулярной сети кровь оттекает в верхних отделах почки в звездчатые вены, затем - в междольковые и дуговые. Затем она поступает в междолевые и почечную вены, которые сопровождают на всем протяжении одноименные артерии.
Мозговое вещество снабжают кровью истинные прямые артерии, которые берут начато от дуговых артерий, и ложные прямые артерии, отходящие от выносящих артериол юкстамедуллярных нефронов.
почечное тельце образовано сосудистым клубочком и двустенной капсулой клубочка
КАПСУЛА состоит из внутреннего и наружного листков, наружный листок образован однослойным плоским эпителием, внутренний- сделан из клеток - подоцитов; внутренний листок окружает капилляры сосудистого клубочка и имеет общую с ними базальную мембрану; подоциты, кроме других функций, образуют базальную мембрану и участвуют в ее обновлении
СОСУДИСТЫЙ КЛУБОЧЕК состоит из капилляров, капилляры фенестрированного типа, базальная мембрана общая как для капилляра, так и для внутреннего листка капсулы; базальная мембрана толстая, трехслойная; капилляры сосудистого клубочка образуются за счет разветвления приносящей артериолы, при выходе из почечного тельца капилляры соединяются с образованием выносящей артериолы
ПОЛОСТЬ КАПСУЛЫ сообщается с просветом проксимального извитого канальца, в полость капсулы фильтруется первичная моча, которая из полости капсулы сразу попадает в проксимальный извитой каналец
ПОЧЕЧНЫЙ ФИЛЬТР - барьер между кровью и первичной мочой состоит из: 1) фенестрированного эндотелия капилляров сосудистого клубочка; 2) толстой трехслойной базальной мембраны и 3) подоцитов - клеток внутреннего листка капсулы (см.рисунок ниже)
МЕЗАНГИЙ - область, находящаяся между капиллярами, где они не покрыты подоцитами; мезангий образован рыхлой соединительной тканью, содержащей несколько видоизмененные фибробласты, называемые мезангиальными клетками, они участвуют в обновлении базальной мембраны капилляров и подоцитов, могут образовывать ее новые компоненты и фагоцитировать старые
ФУНКЦИЯ ПОЧЕЧНОГО ТЕЛЬЦА - образование (фильтрация) первичной мочи
проксимальный извитой каналец образован однослойным призматическим каемчатым эпителием; эпителиальные клетки имеют микроворсинки на апикальной поверхности и радиальную исчерченность в базальной части клеток
проксимальный прямой каналец имеет такое же строение, как и проксимальный извитой
петля нефрона (петля Генле) состоит из нисходящей и восходящей частей
нисходящая часть и начальная часть восходящей образованы однослойным плоским эпителием, они также называются тонким канальцем
восходящая часть (или толстый каналец , или дистальный прямой каналец ) образована однослойным кубическим эпителием
дистальный извитой каналец образован однослойным кубическим эпителием
собирательная трубочка в начальных отделах образована однослойным кубическим эпителием, в конечных - однослойным призматическим эпителием
2. Простые и сложные рефлекторные дуги, составные элементы. Нейронная теория, и её основоположники.
В состав простой рефлекторной дуги могут входить либо только две клетки - чувствительная и двигательная - двучленная дуга (например дуга сухожильного рефлекса), либо три - чувствительная, вставочная и двигательная клетки (такой рефлекс замыкается в спинном мозге, к примеру, при неосознанном отдёргивании конечности в ответ на болевой раздражитель) - это трёхчленная дуга. Сложная рефлекторная дуга содержит в своем составе больше трех нейронов.
Под нейронной теорией понимают общее учение о строении нервной ткани, согласно которому вся нервная система состоит из огромного количества структурных единиц - нейронов, соединенных в различные, более или менее сложные , комплексы.
3. Определение клетки. Органеллы цитоплазмы: понятие и классификация. Структурная, химическая и функциональная характеристика органелл, составляющих цитоскелет клеток. Строение и значение центриолей, ресничек и жгутиков.
Клетка - основная наименьшая единица живой материи, состоящая из ядра и цитоплазмы и обладающая основными свойствами «живого»: обменом веществ и энергии, способностью расти, дифференцироваться, отвечать на раздражение извне, самовоспроизводиться.
Цитоплазма клетки включает в себя прозрачную бесструктурную гишютазму. органеллы- или органоиды - живые и активно работающие части клетки, и включения, представляющие собой продукт жизнедеятельности клетки, пассивный запас каких-либо веществ.
Цитоплазма отделена от окружающей клетку среды и от соседних клеток цитолеммой.
Ядро имеет в своем составе ядерную оболочку, хроматин, ядрышко и кариоплазму (нуклеоплазму).
Цитолемма выполняет разграничительную функцию и регулирует движение ионов и молекул в клетку и из клетки, а также участвует в процессах фагоцитоза, пиноцитоза и экзоцитоза. Цитолемма представляет собой элементарную биологическую мембрану, состоит из двойного слоя липидов и белков - интегральных, полуинтегральных и периферических (транспортных, или белков-переносчиков). Кроме того, с липидами и белками связаны молекулы углеводов, образуя с ними сложные соединения - гликолипиды и гликопротеиды. Они формируют надмембранный комплекс - гликокаликс, в составе которого есть структуры, способные специфически связывать определенные химические вещества и называемые рецепторами. С внутренней стороны мембраны располагается подмембранный (субмембранный) комплекс, включающий в себя микрофиламенты. микрофибриллы и микротрубочки цитоскелета, а также актомиозиновый комплекс.
Органеллы общего значения мембранного строения
Эндотазматическая сеть (ЭПС) - система канальцев и уплощенных цистерн. ЭПС, к наружной поверхности которой прикреплены рибосомы, называется гранулярной, она способна к синтезу белка. Гладкая ЭПС не имеет рибосом и связана с метаболизмом (синтез и расщепление) углеводов и липидов. Здесь же возможен синтез стероидных гормонов, обезвреживание снотворных веществ и канцерогенов, депонирование ионов кальция (в мышечной ткани). ЭПС является не только системой синтеза, но и системой внутриклеточного транспорта, и в то же время ее элементы способны разделять клетку на компартменты - изолированные зоны, в которых одновременно могут протекать химически несовместимые реакции. Наконец, гладкую ЭПС можно рассматривать как запас готовых эндомембран для регенерации мембранных структур клетки, а оба типа совместно (гладкая + гранулярная ЭПС) - как центр новообразования мембран.
Комплекс Голъджи
Лизосамы
Пероксисомы
Митохондрии
Органеллы общего значения немембранного строения
Рибосамы
Клеточный центр (центросома) - две центриоли, окруженные центросферой (светлой зоной), от которой ра-диально отходят тонкие фибриллы, формирующие астросферу. Центриоли - два цилиндра, лежащие под прямым углом друг к другу. Стенка цилиндра состоит из девяти триплетов микротрубочек. Формула центриоли 9x3+0, так как в центре цилиндра трубочки отсутствуют. Центриоли служат центрами формирования всех микротрубочек клетки: здесь происходит редупликация (удвоение) центриолей перед митозом; синтез микротрубочек ахроматинового веретена деления; здесь же образуются микротрубочки цитоскелета и микротрубочки аппаратов движения клетки - ресничек и жгутиков. Последние представляют собой выросты цитоплазмы, в которых находится система микротрубочек, состоящая из двух центральных и девяти пар периферических. Формула жгутика или реснички 9x2+2, в основании их - базальное тельце, представляющее собой видоизмененную центриоль. Микротрубочки построены из белка тубулина.
Гипоталамус. Гистофизиология нейросекреторных ядер переднего и среднего отделов. Гипоталамо-гипофизарные взаимоотношения и взаимосвязь с периферическими эндокринными органами.
Гипоталамус – центральный эндокринный орган и промежуточный центр ВНС. Обеспечивает регуляию висцеральных функций – нервную, эндокринную.
Передний гипоталамус - крупноклеточные, мультиполярные нейроны, холинэргические. Ядра: 1) супраоптическое ядро – выделяет АДГ (вазопресин), который участвует в регуляции реабсорбции воды в почках, повышении АД. При геперфункции – задерживает воду в организме, стойкое повышение АД. При гипофункции – полиурия, обезвоживание. 2) Паравентрикулярное ядро – вырабатывает гомрмон окситоцин, стимулирует сокращение матки при родах.
Средний гипоталамус – мелкоклеточные нейроны, гипофозитропные гормоны (релизинг факторы). Либерины – стимулируют функцию, статины – тормозят. Они транспортируются по аксонам в срединное возвышение, там попадают в первичную капиллярную сеть, дальше по сосудам доставляются в капилляры аденогипофиза (вторичная капиллярная сеть) к клеткам-мишеням.
Задний гипоталамус – неизучен.
2 группы ядер гипоталамуса: 1) крупноклеточные ПГТ (АДГ) – прямая нейральная связь. Гормон достигает нейрогипофиза и выделяется в кровь. 2) Мелкоклеточные СГТ (релизинг факторы) – выделяют гормоны прямо в кровь в гипоталамусе.
Гипофиз закладывается на 4-5 недели эмбриогенеза. Из крыши первичного рта образуется эпителиальное выпячивание эктодермы (ротовая бухта), которая растет вверх к развивающемуся мозгу. В дальнейшем образуется гипофизарный карман, который отрывается от ротовой эктодермы и становится полым островком эпителия.
Из передней стенки разрастается массивная передняя доля гипофиза, из задней – средняя доля. Щель м/у ними срастается и вместе они образуют аденогипофиз. Из основания промежуточного мозгового пузыря заклядывается гипоталамус. Из него образуется выпячивание, которое растет по направлению к гипофизарному карману. Оно образует воронку 3 желудочка. Проксимальный отдел превращается в гипофизарную ножку, дистальный отдел – разрастается в заднюю долю гипофиза. Когда они срастаются начинается дифференцировка, начинается индуктивное влияние друг на друга.
Снаружи гипофиз покрыт тонкой соединительнотканной капсулой. ОТ нее отходят внутрь соединительнотканные перегородки, в них располагаются кровеносные сосуды, преобладают синусоидные капилляры. Они хорошо развиты, образуют вторичную капиллярную сеть (это касательно только аденогипофиза). М/у прослойками соединительной ткани находятся эпителиальные и железистые клетки.
Клеточный состав передней доли: 1) 2 группы железистых клеток: 1.1) Хромофобные клетки – мелкие, округлой формы клетки, со слабо развитыми органеллами, без секреторных гранул. 1.2) Хромофильные клетки имеет 2 группы: базофильные (крупные клетки, округлые/угловатые, хорошо развиты органеллы, имеется большое количество секреторных гранул, вырабатывает ФСГ, ЛГ, ТТГ, АКТГ) и оксифильные (округлой формы, по размеру меньше базафильных клеток. Хорошо развиты органеллы и секреторные гранулы, вырабатывает СТГ, ЛГ).
Средняя доля – слабоокршанные эпителиальные клетки. Мелкие клетки со слабо окрашенной цитоплазмой, слабо развитыми органеллами, мало секреторных отделов. Они могут образовывать фолликулоподобные структуры. Мелонацитостимулирующий гормон – стимулирует образование пигмента. Липотропный гормон – стимулирует липидный обмен.
Задняя доля: глиальные клетки – питуициты. Ч/з гипофизарную ножку в нейрогипофиз поступают аксоны нейросекреторынх клеток, которые заканчиваются расширением на кровеносных сосудах (накопительные тельца). В них накапливаются гормоны из переднего гипоталамуса, а затем выделяются в кровь (по мере необходимости).
Аденогипофиз развивается из эпителия крыши ротовой полости, имеющей эктодермальное происхождение. На 4-й неделе эмбриогенеза образуется эпителиальное выпячивание этой крыши в виде кармана Ратке. Проксимальный отдел кармана редуцируется, и ему навстречу выпячивается дно 3 желудочка, из которого образуется задняя доля. Из передней стенки кармана Ратке образуется передняя доля, из задней -промежуточная. Соединительная ткань гипофиза формируется из мезенхимы.
Функции гипофиза: 1) регуляция деятельности аденогипофиззависымых эндокринных желез; 2) накопление для нейрогормонов гипоталамуса вазопрессина и окситоцина; 3) регуляция пигментного и жирового обмена; 4) синтез гормона, регулирующего рост организма; 5) выработка нейропептидов (эндорфинов).
Гипофиз представляет собой паренхиматозный орган со слабым развитием стромы. Он состоит из аденогипофиза и нейрогипофиза. Аденогипофиз включает три части: переднюю, промежуточную доли и туберальную часть.
Передняя доля состоит из эпителиальных тяжейтрабекул, между которыми проходят фенестрированные капилляры. Клетки аденогипофиза называются аденоцитами. В передней доле их 2 вида: хромофильные и хромофобные. Хромофильные аденоциты располагаются по периферии трабекул и содержат в цитоплазме гранулы секрета, которые интенсивно окрашиваются красителями и делятся на оксифильные и базофильные.
Оксифильные аденоциты делятся на две группы:
1) соматотропоциты вырабатывают гормон роста (соматотропин), стимулирующий деление клеток в организме и его рост;
2) лактотропоциты вырабатывают лактотропный гормон (пролактин, маммотропин).
Базофильные аденоциты подразделяются также на два вида:
1) тиротропоциты - вырабатывают тиреотропный гормон, этот гормон стимулирует выработку щитовидной железой тиреоидных гормонов;
2) гонадотропоциты подразделяются на два вида - фоллитропоциты вырабатывают фолликулостимулирующий гормон, в женском организме он стимулирует процессы овогенеза и синтез женских половых гормонов эстрогенов. В мужском организме фолликулостимулирующий гормон активирует сперматогенез. Лютропоциты вырабатывают лютеотропный гормон, который в женском организме стимулирует развитие желтого тела и секрецию им прогестерона.
Еще одна группа хромофильных аденоцитов - адренокортикотропоциты. Они лежат в центре передней доли и вырабатывают адренокортикотропный гормон, стимулирующий секрецию гормонов пучковой и сетчатой зонами коры надпочечников.
Средняя доля состоит из прерывистых тяжей базофильных и хромофобных клеток. Имеются кистозные полости, выстланные реснитчатым эпителием и содержащие коллоид белковой природы, в котором отсутствуют гормоны. Аденоциты промежуточной доли вырабатывают два гормона: 1) меланоцитостимулирующий гормон, он регулирует пигментный обмен, стимулирует выработку меланина в коже, адаптирует сетчатку ввидению в темноте, активирует кору надпочечников; 2) липотропин, который стимулирует жировой обмен.
Туберальная зона образована тонким тяжом эпителиальных клеток, окружающих эпифизарную ножку. В туберальной доле проходят гипофизарные портальные вены, соединяющие первичную капиллярную сеть медиального возвышения с вторичной капиллярной сетью аденогипофиза.
Задняя доля или нейрогипофиз имеет нейроглиальное строение. В ней гормоны не вырабатываются, а лишь накапливаются. Сюда поступают по аксонам и депонируются в тельцах Геринга вазопрессин и окситоциннейрогормоны переднего гипоталамуса. Состоит нейрогипофиз из эпендимных клеток - питуицитов и аксонов нейронов паравентрикулярных и супраоптических ядер гипоталамуса, а также кровеносных капилляров и телец Геринга - расширений аксонов нейросекреторных клеток гипоталамуса.
4.Щитовидная железа. Щитовидная железа располагается в области шеи кпереди от гортани и состоит из двух долей, соединенных перешейком. В раннем эмбриональном периоде она развивается из энтодермы начальной части первичной кишки. Ее функция заключается в синтезе гормонов тироксина (Т) и трийодтиронина (Т3), которые необходимы для роста и дифференцировки клеток, регуляции потребления кислорода и основного обмена в организме. Гормоны щитовидной железы влияют на обмен белков, липидов и углеводов. Ткань щитовидной железы состоит из 20-30 млн микроскопических сферических структур, известных как фолликулы щитовидной железы, или тироидные фолликулы. Фолликулы выстланы однослойным эпителием, а находящаяся внутри полость содержит желеобразное вещество - коллоид. Щитовидная железа является единственной эндокринной железой, секреторный продукт которой запасается в очень больших количествах. Этот процесс необычен еще и тем, что гормоны накапливаются в коллоиде внеклеточно. У человека содержание гормонов в фолликулах оказывается достаточным, чтобы обеспечить потребности организма в течение периода длительностью до 3 мес. Коллоид щитовидной железы (тироидный коллоид) включает гликопротеин с высокой молекулярной массой (660 кДальтон) - тироглобулин. На срезах фолликулярные клетки варьируют по форме от плоских до столбчатых, а фолликулы характеризуются исключительно разнообразным диаметром. Железа покрыта капсулой из рыхлой соединительной ткани, от которой в глубь паренхимы отходят перегородки (септы). По мере того, как септы постепенно истончаются, они преобразуются в тонкие неправильной формы прослойки соединительной ткани, образованные, главным образом, ретикулярными волокнами, которые достигают всех фолликулов, отделяя их друг от друга. Щитовидная железа является органом с чрезвычайно сильно развитой сосудистой системой, обширной сетью кровеносных и лимфатических капилляров, окружающей фолликулы. Эндотелиальные клетки этих капилляров, как и в других эндокринных железах, - фенестрированные. Такое строение облегчает транспорт молекул между клетками железы и кровеносными капиллярами. Морфологические особенности фолликулов щитовидной железы варьируют в зависимости от участка железы и ее функциональной активности. Внутри одной и той же железы более крупные фолликулы, заполненные коллоидом и выстланные кубическим или плоским эпителием, обнаруживаются рядом с фолликулами, которые образованы столбчатым эпителием. Несмотря на такие различия, если фолликулярный эпителий, в среднем, является плоским, то такую железу считают гипоактивной. Эпителий щитовидной железы располагается на базальной пластинке. Его клетки обладают характеристиками, свидетельствующими о том, что они одновременно синтезируют, секретируют, поглощают и переваривают белки. Базальная часть этих клеток содержит хорошо развитую гранулярную эндоплазматическую сеть (грЭПС). Ядро - обычно округлое и располагается в центре клетки. В апикальной части находятся комплекс Гольджи, состоящий из нескольких компонентов, и мелкие секреторные гранулы, содержимое которых сходно с фолликулярным коллоидом. В этом участке располагаются многочисленные лизосомы диаметром 0,5-0,6 мкм и отдельные крупные фагосомы. Клеточная мембрана апикального полюса образует умеренное число микроворсинок. Митохондрии и цистерны гранулярной эндоплазматической сети (грЭПС) рассеяны по всей цитоплазме. Коллоид заполняет полость фолликула, хотя он часто отделяется от границы клеток в результате артефактов. Окраска коллоида вариабельна - иногда она базофильна, иногда - ацидофильна. Тироглобулин окрашивается методом Шиффа с йодной кислотой (ШИК-реакция) вследствие высокого содержания в нем Сахаров. Другим типом клеток, имеющимся в щитовидной железе, являются парафолликулярные, или С-клетки, которые обнаруживаются в составе фолликулярного эпителия или образуют изолированные группы между фолликулами щитовидной железы. Парафолликулярные клетки крупнее, чем клетки фолликулов щитовидной железы, и под световым микроскопом имеют более светлую окраску. В них содержится небольшое количество цистерн гранулярной эндоплазматической сети (грЭПС), удлиненные митохондрии и крупный комплекс Гольджи. Наиболее специфической отличительной чертой этих клеток являются многочисленные мелкие (диаметром 100-180 нм) гранулы, содержащие гормон. Парафолликулярные клетки синтезируют и секретируют кальцитонин - гормон, главное действие которого состоит в снижении уровня кальция в крови путем угнетения резорбции кости. Секреция кальцитонина стимулируется повышением концентрации кальция в крови.
5.Околощитовидные железы. Околощитовидные железы - четыре мелких (3x6 мм) железы с общей массой около 0,4 г - располагаются за щитовидной железой, по одной у каждого края верхних и нижних полюсов, обычно внутри капсулы, покрывающей доли щитовидной железы. Иногда они погружены в ткань щитовидной железы. Околощитовидные железы развиваются из глоточных карманов - верхние железы из четвертого кармана, а нижние железы - из третьего. Иногда их обнаруживают в средостении, где они могут располагаться рядом с тимусом, который развивается из тех же глоточных карманов. Каждая околощитовидная железа покрыта соединительнотканной капсулой. От капсулы вглубь железы отходят септы, которые соединяются с ретикулярными волокнами, поддерживающими удлиненные скопления секреторных клеток. Эндокринные клетки околощитовидной железы располагаются в виде тяжей. Имеются два типа клеток: главные и оксифильные. Главные клетки - мелкие полигональные клетки с везикулярным ядром и бледноокрашенной, слегка ацидофильной цитоплазмой. Электронная микроскопия выявляет в их цитоплазме неправильной формы гранулы (диаметром 200-400 нм). Это секреторные гранулы, содержащие паратгормон, который представляет собой полипептид в активной форме. Оксифильные клетки образуют более малочисленную популяцию. Это более крупные полигональные клетки, цитоплазма которых содержит множество ацидофильных митохондрий с многочисленными кристами. Функция оксифильных клеток неизвестна. С возрастом секреторные клетки замещаются адипоцитами. У пожилых людей жировые клетки занимают более 50% объема железы.
6.Надпочечники. Строение, функции надпочечника. Надпочечники представляют собой парные органы, которые располагаются вблизи верхних полюсов почек и погружены в жировую ткань. Они имеют вид уплощенных образований полулунной формы; у человека их длина составляет около 4-6 см, ширина- 1-2 см и толщина- 4-6 мм. Вместе они весят около 8 г, но их вес и размеры варьируют в зависимости от возраста и физиологического состояния индивидуума. Изучение свежего среза надпочечника показывает, что в нем имеются два концентрически расположенных слоя: желтый, лежащий на периферии слой, - корковое вещество надпочечника и красновато-коричневый центрально расположенный слой - мозговое вещество надпочечника. Корковое вещество надпочечника и его мозговое вещество можно рассматривать как два органа с различными происхождением, функциями и морфологическими характеристиками, которые объединились в один в ходе эмбрионального развития. Они развиваются из различных эмбриональных листков. Корковое вещество происходит из целомического эпителия, а клетки мозгового вещества - из нервного гребня, из которого развиваются также и клетки симпатических узлов. Общая гистологическая организация надпочечника типична для эндокринной железы - клетки как его коркового, так и мозгового вещества сгруппированы в тяжи, лежащие вдоль капилляров. От капсулы из плотной соединительной ткани, покрывающей надпочечник, в глубь органа отходят тонкие септы (трабекулы). Строма состоит, главным образом, из богатой сети ретикулярных волокон, которая поддерживает секреторные клетки. Кровоснабжение надпочечников Надпочечники питаются кровью из нескольких артерий, которые проникают в них в различных участках по их периферии. Ветви этих артерий можно подразделить на три группы: артерии, которые несут кровь к капсуле; корковые артерии, разветвляющиеся на капилляры, которые кровоснабжают железистые клетки коркового вещества и в конечном итоге достигают капилляров мозгового вещества; и мозговые артерии, которые проходят сквозь корковое вещество и образуют обширную капиллярную сеть в мозговом веществе. Клетки мозгового вещества, таким образом, омываются как артериальной кровью из мозговых артерий, так и венозной кровью, протекающей по капиллярам коркового вещества. Эндотелий капилляров чрезвычайно истончен и содержит мелкие фенестры, закрытые диафрагмами. Под эндотелием располагается непрерывная базальная пластинка. Капилляры мозгового вещества совместно с капиллярами, питающими корковое вещество, образуют мозговые вены, которые сливаются, в результате чего образуется надпочечниковая вена.
Дэвид Г. П. Стритен, Арнольд М. Мозес, Майрон Миллер (David H . P . Streeten , Arnold M . Moses , Myron Miller )
Существуют две во многом независимые гипоталамо-гипофизарные системы, включающие нейроны супраоптических и паравентрикулярных ядер, аксоны которых проходят через ножку гипофиза в заднюю его долю. Гормоны (вазопрессин и окситоцин), образующиеся в разных ганглионарных клетках, мигрируют по аксонам в составе белков-предшественников, куда входят и нейрофизины. В нервных окончаниях нейрогипофиза они хранятся в секреторных гранулах, откуда путем экзоцитоза гормоны со своими нейрофизинами выделяются в кровяное русло. Вазопрессин, или антидиуретический гормон (АВП, или АДГ), контролирует в основном сохранение воды в организме, и его секреция сопряжена с активностью центра жажды, который регулирует потребление жидкости. Окситоцин стимулирует сокращения мускулатуры матки и секрецию молока.
Секреция и действие вазопрессина
Аргинин-вазопрессин (АВП) представляет собой нонапептид, состоящий из 6 аминокислот, замкнутых в кольцо, к которому в виде боковой цепи присоединены еще 3 аминокислоты.
Механизм действия. Действуя на свои У 2 -рецепторы в дистальных отделах почечных канальцев, АВП препятствует экскреции воды и способствует концентрации мочи путем повышения гидроосмотического тока воды из просвета канальцев через клетки собирательных трубочек в интерстициальное пространство мозгового слоя почек. Именно благодаря этому поддерживается постоянство осмоляльности и объема жидких сред организма. В высоких концентрациях АВП действует на У 1 -рецепторы, вызывая сужение сосудов, что может иметь место при резкой гипотензии или при инфузии вазопрессина в лечебных целях при кровотечении из варикозно-расширенных вен пищевода.
АВП, секретируемой аксонами, оканчивающимися в головном мозге, может принимать участие в процессах обучения и памяти, а секретируемый волокнами срединного возвышения - влиять на секрецию кортикотропина.
Нормальные уровни гормона. Концентрацию АВП в плазме и моче можно определить радиоиммунологическим методом. Результаты выражают либо в единицах действия, исходя из прессорной активности препарата у крыс, либо в весовых количествах очищенного вазопрессина. Биологическая активность аргинин-вазопрессина составляет примерно 400 ЕД/мг (1 мкЕД=2,5 пг). Гипофиз человека в условиях обычного потребления жидкости содержит около 8 ЕД АВП. В тех же условиях концентрация АВП в плазме периферической крови человека колеблется от 1 до 3 мкЕД/мл. Уровень АВП в крови зависит от времени суток, достигая максимального поздно ночью и рано утром и опускаясь до минимального после полудня. В условиях нормальной гидратации у здорового человека гипофиз за сутки выделяет 400-550 мЕД АВП, а с мочой экскретируется 10-35 мЕД. При 24-28-часовой дегидратации количество секретируемого гормона возрастает в 3-5 раз, что сопровождается повышением его уровня в плазме крови и моче.
Метаболизм. АВП инактивируется в печени и почках преимущественно путем отщепления концевого глицинамида с образованием биологически неактивного вещества. Примерно 7-10% секретируемого АВП выводится с мочой в виде активного гормона.
Осморегуляция. В нормальных условиях секрецию АВП регулируют главным образом осморецепторы, расположенные в гипоталамусе. Изменения концентрации растворенных в плазме веществ, не проникающих через клеточную мембрану, сопровождаются изменением объема осморе-цепторных клеток, что в свою очередь меняет электрическую активность нейронов, контролирующих секрецию АВП. Осмотические сдвиги, стимулирующие секрецию АВП, увеличивают и его образование. Сервомеханизм между секрецией АВП и эффективной осмоляльностью плазмы в норме поддерживает последнюю в очень узких пределах. Средняя осмоляльность плазмы у здорового человека после водной нагрузки в количестве 20 мл/кг массы тела составляет 281,7 мосм/кг, а осмоляльность, запускающая секрецию АВП после введения гипертонического солевого раствора на фоне водной нагрузки, - 287,3 мосм/кг. Таким образом, при переходе от полного диуреза до начала антидиуреза под действием гипертонического раствора соли осмоляльность плазмы меняется всего на 5,6 мосм/кг, или на 2%.
Инфузия гипертонического солевого раствора с постоянной скоростью человеку в условиях водной нагрузки приводит к линейному возрастанию осмоляльности плазмы во времени. Однако через какой-то срок, продолжительность которого зависит от скорости инфузии и концентрации солевого раствора, происходит крутое и прогрессирующее падение клиренса свободной воды без сколько-нибудь заметного изменения экскреции растворенных веществ или креатинина. Мы определили осмотический порог для секреции АВП в единицах осмоляльности плазмы к началу антидиуреза в таких условиях. У 73 здоровых испытуемых антидиурез начинался при средней осмоляльности 287 мосм/кг.
Регуляция объемом жидкости. Уменьшение объема плазмы, воспринимаясь рецепторами растяжения в левом предсердии и, вероятно, в легочных венах, стимулирует секрецию АВП путем ослабления топической ингибиторной импульсации из левого предсердия в гипоталамус. Нервные импульсы проходят по блуждающим нервам в ретикулярную формацию среднего и промежуточного мозга и достигают супраоптических и паравентрикулярных ядер, где интегрируются с другими стимулами, влияющими на секрецию АВП. Этот механизм может активироваться положительным давлением в грудной клетке при дыхании, ортостатическим положением тела и расширением сосудов под действием высокой окружающей температуры и направлен на восстановление объема плазмы. Иногда он даже преодолевает осмотическое ингибирование секреции АВП. После уменьшения объема плазмы концентрация АВП может в 10 раз превышать тот его уровень, который обусловливается гипертоничностью плазмы. Увеличение объема плазмы ингибирует секрецию АВП за счет противоположных механизмов, вызывающих диурез и коррекцию гиперволемии. Отрицательное давление в грудной клетке при дыхании, горизонтальное положение тела, отсутствие силы тяжести (что имеет место при космических полетах), погружение в воду и воздействие холода - все это может активировать данный механизм.
Барорецепторная регуляция. Активация каротидных и аортальных барорецепторов в ответ на гипотензию вызывает секрецию АВП. Гипотензия, обусловленная кровопотерей, является наиболее сильным стимулом и иногда сопровождается повышением уровня АВП в плазме до 1000 мкЕД/мл. Такая концентрация АВП может вызывать резкое сужение сосудов, что, по всей вероятности, участвует в нормализации артериального давления.
Нервная регуляция. Стимулирующее и ингибиторное влияние на гипоталамус и, следовательно, на секрецию АВП может опосредоваться нейротрансмиттерами и пептидными нейромодуляторами, такими как ангиотензин II, дофамин и эндорфины. Последним звеном, связывающим нервные пути с нейронами супраоптического ядра, осуществляющими секрецию АВП, является, по-видимому, ацетилхолин. Холинергические и р -адренергические стимулы приводят к секреции АВП, тогда как атропин и а -адренергическая стимуляция тормозят эту секрецию, действуя, очевидно, на уровне гипоталамуса. Эмоциональный стресс, рвота и боль могут преодолевать диурез. Последний может быть вызван гипнотическим внушением, условнорефлекторно и вдыханием углекислоты.
Старение. Процесс старения сопровождается ростом секреции АВП в ответ на повышение осмоляльности плазмы и прогрессирующим увеличением его концентрации в плазме. Эти физиологические сдвиги, по-видимому, обусловливают у лиц пожилого возраста большую задержку воды в организме и гипонатриемию, несмотря на одновременное снижение максимальной концентрирующей способности почек в ответ на АВП. Эти процессы отмечаются у лиц старше 60 лет и с возрастом прогрессируют.
Фармакологические влияния. К фармакологическим средствам, стимулирующим секрецию АВП, относятся никотин, морфин, винкристин, винбластин, циклофосфамид, клофибрат, хлорпропамид и некоторые трициклические противосудорожные вещества и антидепрессанты. Этанол обладает диуретическими свойствами и ингибирует функцию нейрогипофиза. Секрецию АВП ингибируют и некоторые антагонисты наркотиков. В условиях эксперимента хлорпромазин резерпин и фенитоин уменьшают выход АВП из гипофиза и увеличивают его экскрецию с мочой, что приводит к потере жидкости. У человека фенитоин и хлорпромазин также могут ингибировать секрецию АВП и стимулировать диурез.
Реакция АВП на обезвоживание и водную нагрузку. В условиях лишения организма воды возникают как осмотический, так и объемный стимулы к секреции вазопрессина, поскольку при этом увеличивается осмоляльность плазмы и уменьшается ее объем. Максимальная величина осмоляльности мочи при сухоядении варьирует в зависимости от осмоляльности мозгового слоя почек и других внутрипочечных факторов. У здоровых лиц лишение воды в течение 18-24 ч редко приводит к повышению осмоляльности плазмы более 292 мосмоль/кг. Возникающая при этом стимуляция секреции АВП увеличивает его концентрацию в плазме до 6- 10 мкЕД/мл.
Прием жидкости снижает осмоляльность плазмы и увеличивает объем крови, тормозя секрецию АВП через осморецепторный и предсердный волюморецепторный механизмы. Пероральная водная нагрузка в количестве 20 мл/кг приводит у здорового взрослого человека к падению осмоляльности плазмы в среднем до 281,7 мосмоль/кг и в пределах 1-1,5 ч вызывает максимальный диурез, при котором клиренс свободной воды возрастает примерно до 12 мл/мин, а осмоляльность мочи снижается до 40-60 мосмоль/кг. Запаздывание максимального диуреза объясняется тем, что для всасывания воды в кишечнике, разрушения ранее выделившегося вазопрессина и высвобождения почек из-под его действия необходимо время.
Взаимодействие осмотических и объемных стимулов. Как в условиях лишения воды, так и при водной нагрузке объемное и осмотическое влияние на секрецию АВП действуют параллельно. В других ситуациях эти факторы могут конкурировать друг с другом, и небольшие сдвиги в объеме плазмы модифицируют гипертонический стимул к секреции АВП. Обычно осмотические факторы играют основную роль в удержании осмоляльности плазмы в узких границах. Большие изменения в объеме крови (например, при кровотечении) могут демпфировать и даже преодолевать осмотические влияния. Точно так же и гипотензия, активируя барорецепторы, оказывает мощное стимулирующее действие на секрецию АВП, преодолевая, таким образом, одновременные ингибирующие влияния.
Связь между секрецией АВП и потреблением воды, обусловленным жаждой. В нормальных условиях между секрецией АВП и жаждой существует тесная связь, причем и та, и другая регулируются небольшими подъемами и снижениями осмоляльности плазмы. Чувство жажды возникает обычно при возрастании осмоляльности плазмы выше 292 мосмоль/кг. В эксперименте жажда и секреция АВП увеличиваются под влиянием ангиотензина II . При нарушении секреции АВП потеря воды обусловливает гипернатриемию, которая усиливает жажду и потребление жидкости в степени, достаточной для восстановления и сохранения осмоляльности плазмы. С другой стороны, утрата чувства жажды (адипсия) сопровождается некорригируемыми потерями жидкости и гипернатриемией, несмотря на возрастание секреции АВП и экскрецию максимально концентрированной мочи.
Влияние глюкокортикоидов. Гормоны коры надпочечников и задней доли гипофиза оказывают противоположное влияние на экскрецию воды. Кортизол повышает осмотический порог секреции АВП, вызываемой инфузией гипертонического солевого раствора здоровым людям в условиях водной нагрузки. Глюкокортикоиды защищают организм от водной интоксикации и нормализуют нарушенную при недостаточности надпочечников реакцию на водную нагрузку.
Хотя снижение способности разводить мочу у больных с недостаточностью надпочечников отчасти может быть следствием повышенного уровня АВП в крови, глюкокортикоиды оказывают и прямое действие на почечные канальцы, снижая их проницаемость для воды и увеличивая экскрецию бессолевой воды даже в отсутствие АВП.
Клеточные механизмы активности АВП. АВП связывается со специфическими рецепторами V 2 на контралюминальной поверхности канальцев; 2) гормонрецепторный комплекс «сопрягается» с аденилатциклазой через белок, регулируемый гуаниннуклеотидом, и активирует ее, причем это происходит на той же контралюминальной поверхности; 3) возрастает продукция циклического АМФ; 4) циклический АМФ перемещается к люми-нальной мембране клетки, где активирует связанную с этой мембраной протеинкиназу; 5) активированная протеинкиназа обусловливает фосфорилирование мембранных белков и 6) увеличивается проницаемость люминальной мембраны по отношению к воде. Образовавшийся под действием АВП циклический АМФ может инактивироваться фосфодиэстеразой, превращающей его в 5"-АМФ. АВП стимулирует также продукцию простагландина Е 2 который в свою очередь действует в качестве ингибитора системы активации аденилатциклазы по механизму обратной связи.
Перемещение воды через каналец зависит от целостности системы микротрубочек в эпителиальных клетках. Перечисленные выше биохимические процессы приводят к пассивному току воды по осмотическому градиенту через стенку собирательного канальца. Физиологическое действие АВП сопровождается анатомическими изменениями, к которым относятся набухание клеток, их вакуолизация, увеличение интерстициального пространства в мозговом веществе почек и расширение межклеточных пространств в собирательных протоках. Последнее указывает на то, что реабсорбция жидкости при вызванном АВП антидиурезе осуществляется отчасти и через межклеточные каналы.
На действие АВП могут влиять различные катионы и фармакологические средства. Кальций и литий уменьшают реакцию аденилатциклазы на вазопрессин. Литий препятствует также осуществлению последующих биологических процессов. Аналогично и влияние недостаточности калия. Демеклоциклин ограничивает степень вазопрессиновой стимуляции аденилатциклазы и ингибирует также цАМФ-зависимую протеинкиназу. В отличие от этого хлорпропамид усиливает вазопрессиновую активацию аденилатциклазы.
Недостаточность вазопрессина: несахарный диабет
При несахарном диабете центрального генеза способность почек сохранять воду в организме нарушается вследствие недостаточной секреции АВП в ответ на нормальные физиологические стимулы.
Патофизиология. Недостаточная секреция вазопрессина в ответ на соответствующие стимулы может быть результатом повреждения нескольких функциональных звеньев физиологической цепи процессов, регулирующих выброс гормона в кровоток. С концептуальных позиций можно выделить четыре типа центрального несахарного диабета. Больные с патологией первого типа обнаруживают крайне незначительное повышение осмоляльности мочи при увеличении осмоляльности плазмы и отсутствие признаков секреции АВП при введении гипертонического солевого раствора. Такие больные практически лишены мобилизуемого АВП. При втором типе заболевания в условиях дегидратации наблюдается резкое возрастание осмоляльности мочи, но при введении солевого раствора отсутствует осмотический порог. У таких больных нарушен осморецепторный механизм, но сохранена способность секретировать АВП в ответ на гиповолемию или тяжелую дегидратацию. У больных третьего типа при увеличении осмоляльности плазмы происходит некоторое повышение осмоляльности мочи, но осмотический порог секреции АВП повышен. У таких больных механизм секреции заторможен, а осморецептор имеет, так сказать, более высокую точку настройки. При заболевании четвертого типа кривая зависимости между осмоляльностью мочи и плазмы сдвинута вправо. Секреция АВП у таких больных начинается при той же осмоляльности плазмы, что и в норме, но в количественном отношении оказывается ниже нормальной.
У больных с несахарным диабетом второго - четвертого типов в ответ на тошноту, никотин, метахолин, хлорпропамид или клофибрат может возникать выраженный антидиурез, что указывает на достаточность синтеза и запасов АВП для реализации способности адекватного концентрирования мочи при наличии соответствующего стимула к секреции гормона. В редких случаях у больных со вторым - четвертым типами патологии может иметь место бессимптомная гипернатриемия, сопровождающаяся лишь незначительными признаками несахарного диабета.
Этиология. Несахарный диабет часто начинается в детстве или раннем зрелом возрасте (медиана возраста начала - 21 год). Мужчины болеют чаще, чем женщины. К основным причинам несахарного диабета относятся следующие. 1. Неопластические или инфильтративные повреждения гипоталамуса или гипофиза, включая хромофобные аденомы, краниофарингиомы, герминомы, пинеаломы, метастазы опухолей, лейкоз, гистиоцитоз Х и саркоидоз. 2. Хирургические или лучевые вмешательства на гипоталамусе или гипофизе или применение разрушающей лучевой терапии. Несахарный диабет, явившийся следствием хирургических вмешательств, развивается обычно через 1-6 дней после операции и часто исчезает через несколько дней; спустя еще 1-5 дней он либо продолжает отсутствовать, либо возобновляется и становится хроническим. Удаление задней долги гипофиза вызывает постоянный несахарный диабет только в том случае, если ножка гипофиза перерезана достаточно высоко, чтобы вызвать ретроградную дегенерацию большинства нейронов супраоптического ядра. 3. Идиопатический несахарный диабет обычно начинался в детстве и редко (менее чем в 20% случаев) сопровождался дисфункцией передней доли гипофиза. Такой диагноз можно устанавливать лишь после тщательных, но безуспешных поисков любых признаков опухоли, инфильтративного процесса, сосудистого повреждения или других возможных причин недостаточности АВП. Наличие гипопитуитаризма, гиперпролактинемии или рентгенологических признаков повреждения внутри или выше турецкого седла должно стимулировать продолжение поисков причины заболевания через 3-12 мес. Уверенность в диагнозе идиопатического несахарного диабета возрастает с увеличением длительности периода получения отрицательных результатов исследования. Имеются сообщения, что при идиопатическом несахарном диабете в супраоптическом и паравентрикулярном ядрах уменьшено число нейронов. В редких случаях доку монтирована доминантная наследуемость заболевания .
Клинические проявления. При несахарном диабете почти всегда присутствуют полиурия, чрезмерная жажда и полидипсия. Для заболевания характерно внезапное возникновение этих симптомов - независимо оттого, проявляется ли оно впервые или в результате исчезновения эффектов вводимого вазопрессина в условиях длительной терапии. В тяжелых случаях моча выглядит очень светлой, а ее количество может становиться огромным (до 16-24 л в сутки), что требует мочеиспускания каждые 30-60 мин днем и ночью. Чаще, однако, объем мочи увеличивается лишь умеренно (2,5-6 л в сутки), а иногда он может быть менее 2 л в сутки, что у части больных вообще не вызывает жалоб. В тяжелых случаях концентрированность мочи (менее 290 мосмоль/кг, удельный вес менее 1,010) ниже, чем сыворотки, но при легком несахарном диабете может быть и выше (290-600 мос-моль/кг).
Небольшое повышение осмоляльности сыворотки, обусловленное гипотоничной полиурией, стимулирует жажду. Больные поглощают большое количество жидкости, предпочитая охлажденные напитки, и часто проявляют чрезмерную озабоченность их доступностью. Хотя жажда возникает, вероятно, вторично по отношению к потере воды, введение вазопрессина зачастую снимает или уменьшает жажду даже без питья.
Нормальная функция центра жажды обеспечивает тесную сопряженность полидипсии и полиурии, так что дегидратация редко проявляется чем-то иным, кроме легкого повышения концентрации натрия в сыворотке. Однако без адекватного восполнения экскретируемой воды дегидратация становится выраженной и приводит к слабости, лихорадке, психическим расстройствам, прострации и смерти. Это происходит на фоне возрастания осмоляльности сыворотки и концентрации натрия в ней, которая иногда превышает 175 мэкв/л. При несахарном диабете вследствие повреждения преоптического ядра адипсия отсутствует, но при нарушении функции гипоталамического центра жажды из-за вовлечения его в патологический процесс адипсия может иметь место. Чаще дегидратация возникает в бессознательном состоянии, связанном с наркозом при хирургических операциях, тепловым ударом или другими причинами. Больным несахарным диабетом, находящимся без сознания, особенно опасно вводить большие объемы изотопического солевого раствора внутривенно или гиперосмолярные белковые смеси через желудочный зонд без одновременного введения достаточных количеств воды.
В редких случаях осложнением полиурии может быть гидронефроз; это особенно характерно для тех больных, которые из-за атонии мочевого пузыря, стриктур мочеточников или других причин не в состоянии полностью опустошать мочевой пузырь.
Диагностические тесты. Диагностика несахарного диабета основана на том, что повышение осмоляльности плазмы, вызываемое лишением жидкости или введением гипертонического солевого раствора, сопровождается меньшей, чем в норме, секрецией АВП. Это можно установить, определив уровень АВП в плазме или моче, или продемонстрировав недостаточный прирост осмоляльности мочи при экзогенном введении супрамаксимальных количеств вазопрессина. Определения осмоляльности плазмы и мочи настолько просты и надежны, что необходимость определять уровень АВП возникает лишь в редких случаях, когда результаты определения осмоляльности оказываются недостаточно четкими.
Оценка зависимости между осмоляльностью плазмы и мочи. Если результаты нескольких одновременных определений осмоляльности плазмы и мочи у больного с полиурией находятся на диаграмме значительно правее затемненной области, это говорит о возможном диагнозе центрального или нефрогенного несахарного диабета. Последний более вероятен, если повышена концентрация АВП в плазме или моче или если реакция на экзогенно вводимый АДГ оказывается ниже нормальной. Сопоставление осмоляльности плазмы и мочи особенно целесообразно в послеоперационном периоде у нейрохирургических больных. Это помогает быстро дифференцировать несахарный диабет от последствий парентерального введения избытка жидкости.
Дегидратациониый тест. Сопоставление осмоляльности мочи в условиях дегидратации с таковой после введения вазопрессина служит простым и надежным способом диагностики несахарного диабета и дифференцирования недостаточности вазопрессина от других причин полиурии.
Максимальная способность концентрировать мочу у разных людей широко варьирует, и у больных с неспецифическими заболеваниями, у которых АВП продуцируется в достаточных количествах, нельзя определить абсолютные нижние границы «нормы». Невозможно разграничить достаточную и недостаточную секрецию АВП просто по уровню осмоляльности мочи, устанавливающемуся после определенных периодов воздержания от питья. С другой стороны, если на фоне длительной дегидратации введение вазопрессина вызывает дальнейший рост осмоляльности мочи, то это служит веским доказательством существования недостаточности вазопрессина.
Методика. 1. Достаточно долгое воздержание от питья, способное обеспечить стабильную ежечасную осмоляльность мочи (ежечасный прирост менее 30 мосмоль/кг по крайней мере в течение 3 ч подряд). Это обычно сопровождается уменьшением массы тела не менее чем на 1 кг. Больным, у которых суточный объем мочи превышает 10л, прекратить прием жидкости следует между 4 и 6 ч утра с тем, чтобы обеспечить тщательное наблюдение за ними. Тест заканчивают, когда масса тела уменьшится на 2 кг или ухудшится клиническое состояние больного. Больным с полиурией при объеме мочи менее 10 л в сутки прием жидкости следует прекратить между 6 ч вечера и полуночью и продолжать тест до полудня следующего дня.
2. Пробы мочи для определения осмоляльности берут ежечасно с 6 ч утра не менее чем до полудня, а лучше до тех пор, пока осмоляльность трех последовательных проб не станет стабильной.
3. В 11 ч утра (если дегидратацию начали в 6 ч утра) или после третьего стабильного результата определения осмоляльности мочи больному дают вазопрессин - 5 ЕД препарата в водном растворе, или 1 мкг десмопрессина подкожно, или 10 мкг десмопрессина путем орошения слизистой оболочки носа.
4. Осмоляльность плазмы определяют сразу после введения вазопрессина, а осмоляльность мочи - в порции, собранной в течение 1 ч после его введения.
Во время дегидратационного теста необходимо следить за жизненно важными функциями, хотя при соблюдении данной методики побочные эффекты возникают редко.
Интерпретация полученных результате в. У лиц с нормальной функцией гипофиза осмоляльность мочи после инъекции вазопрессина возрастает не более чем на 9%, какова бы ни была максимальная ее осмоляльность после одной дегидратации (см. рис. 323-3). При несахарном диабете центрального генеза прирост осмоляльности мочи после введения вазопрессина превышает 9%. Чтобы дегидратация была достаточной, осмоляльность плазмы до инъекции вазопрессина должна превышать 288 мосмоль/кг. У больных с полиурией, обусловленной патологией почек, снижением уровня калия или нефрогенным несахарным диабетом, осмоляльность мочи в условиях дегидратации увеличивается незначительно, а после инъекции вазопрессина более не возрастает. Больным, потребляющим много воды (первичная полидипсия), часто требуется более длительный период сухоедения, чтобы осмоляльность плазмы достигла 288 мосмоль/кг и чтобы осмоляльность мочи вышла на плато. После введения экзогенного вазопрессина осмоляльность мочи у них возрастает не больше чем на 9%.
Основные полиурические синдромы
Первичные нарушения потребления или выделения воды
А. Избыточное потребление воды
1. Психогенная полидипсия
2. Поражение гипоталамуса: гистиоцитоз X, саркоидоз
3. Полидипсия, вызванная фармакологическими средствами [тиоридазин, хлорпромазин, антихолннергические средства (сухость во рту)]
Б. Недостаточная канальцевая реабсорбция фильтруемой воды
1. Недостаточность вазопрессина а) несахарный диабет центрального генеза б) торможение секреции АВП фармакологическими средствами (антагонисты наркотиков)
2. Нечувствительность почечных канальцев к АВП а) нефрогенный несахарный диабет (врожденный и семейный) б) нефрогенный несахарный диабет (приобретенный)
Ряд хронических почечных заболеваний, после обструктивной уропатии, односторонний стеноз почечной артерии, после пересадки почки, после острого некроза канальцев
Недостаточность калия, включая первичный альдостеронизм
Хронические гиперкальциемии, включая гиперпаратиреоз
Вызванный фармакологическими средствами: литием, метоксидолурановым наркозом, демеклоциклином
Различные системные заболевания: множественная миелома, амилоидоз, серповидно-клеточная анемия, синдром Шегрена
Первичные нарушения почечной абсорбции растворенных веществ (осмотический диурез)
А. Глюкоза: сахарный диабет
Б. Соли, особенно хлорид натрия
1. Различные хронические заболевания почек, особенно хронический пиелонефрит
2. После приема различных диуретиков, включая маннитол
3. Определяют осмоляльность всех проб мочи и плазмы (или сыворотки) крови. Рассчитывают клиренс свободной воды и данные помещают на график.
4. В каждой пробе крови, взятой для определения осмоляльности плазмы, целесообразно определить концентрацию АВП (если, конечно, имеется надежный набор для радиоиммунологического исследования).
Интерпретация. Анализ данных должен показать, происходит ли внезапное, имеющее четкое начало прогрессирующее падение клиренса свободной воды. Осмотический порог секреции АВП определяют путем проецирования точки начала падения клиренса свободной воды на прямую, отражающую зависимость осмоляльности плазмы от времени. При таком определении осмотический порог у человека в условиях водной нагрузки в норме составляет 287,3 ± 3,3 мосмоль/кг (средняя ± стандартное отклонение). Осмотический порог можно рассчитать также, поместив значения концентрации АВП в плазме крови против одновременно регистрируемых значений ее осмоляльности и определив тот уровень последней, при котором начинается линейный рост концентрации АВП. При таком подходе можно использовать и результаты определения АВП в моче. У большинства больных несахарным диабетом видимый осмотический порог отсутствует, т. е. даже при возрастании осмоляльности плазмы выше 300 мосмоль/кг не происходит падения клиренса свободной воды. Однако у некоторых больных, несмотря на наличие несахарного диабета, все же может сохраняться высокий или нормальный осмотический порог.
Дифференциальная диагностика. Несахарный диабет необходимо отличать от других видов полиурии, которые характеризуются отсутствием реакции почечных канальцев на эндогенный вазопрессин. Поэтому эти виды полиурии можно распознать по отсутствию реакции и на вводимый АВП. Некоторые из них удается диагностировать по анамнезу (например, введение лития или маннитола, операция под метоксифлурановым наркозом или пересадка почки, имевшие место в недавнем прошлом; при других - диагностике помогают физикальное обследование или простые лабораторные анализы (глюкозурия, почечная патология, серповидно-клеточная анемия, гиперкальциемия или снижение уровня калия, в том числе первичный альдостеронизм).
Врожденный нефрогенный несахарный диабет представляет собой редкую, обычно семейную форму полиурии, обусловленную нечувствительностью к АВП. Это заболевание чаще всего диагностируют по отсутствию уменьшения полиурин или роста осмоляльности мочи после инъекции вазопрессина. Таких больных можно отличить от лиц с вазопрессинзависимым несахарным диабетом по семейному характеру заболевания (что редко наблюдается при несахарном диабете) и отсутствию резкого уменьшения суточного объема мочи при введении вазопрессина или десмопрессина (что характерно для вазопрессинзависимого несахарного диабета). Иногда больные с нефрогенным несахарным диабетом реагируют на вазопрессин, вводимый.на фоне постоянной осмоляльности мочи (плато), 40-50% увеличением ее осмоляльности. Такая реакция занимает промежуточное положение между реакциями больных с легким и тяжелым несахарным диабетом. Когда с помощью этих методов не удается с определенностью разграничить нефрогенный и центральный несахарный диабет, диагноз нефрогенного несахарного диабета устанавливают при обнаружении повышенной по отношению к осмоляльности плазмы концентрации АВП в плазме или моче или повышенной по отношению к осмоляльности мочи концентрации АВП.
Первичная полидипсия. Первичную, или психогенную, полидипсию иногда бывает трудно отличить от несахарного диабета. Встречаются две формы этого заболевания: хроническое чрезмерное потребление воды, приводящее к гипотонической полиурии (что часто путают с несахарным диабетом), и периодическое потребление очень больших количеств воды, что также может привести к гипонатриемии из-за разведения плазмы, несмотря па экскрецию даже очень разведенной мочи.
Полидипсия и полиурия при этом заболевании обычно нестабильны, тогда как при несахарном диабете они выступают как постоянные симптомы. У таких больных, как правило, нет ночной полиурии, так как длительно существующая полиурия может обусловить значительное увеличение емкости мочевого пузыря и тем самым сделать мочеиспускания более редкими. Зачастую эти больные подвержены эмоциональным нарушениям. Синдром первичной полидипсии встречается у некоторых больных с нервной анорексией, которые потребляют огромные количества воды на фоне резкого ограничения пищи. С увеличением потребления пищи объем потребляемой воды может существенно падать. Изредка у больных с хроническим избыточным потреблением жидкости наблюдаются повреждения центральной нервной системы, хотя для таких повреждений более характерны адипсия или гиподипсия.
При периодическом потреблении больших количеств жидкости, даже без нарушения способности разводить мочу, могут возникать водная интоксикация и гипонатриемия, обусловленные разведением плазмы. Это встречается довольно редко, так как здоровый взрослый человек может экскретировать воду без растворенных веществ со скоростью 10- 14 мл/мин, а потребление столь больших количеств воды, которые превышали бы этот порог и вызывали гипонатриемию из-за разведения плазмы, наблюдается лишь в исключительных случаях. Синдром водной интоксикации на фоне нормальной способности разводить мочу обнаружен у лиц, пользующихся большой емкости клизмами, потребляющих чрезмерные количества пива или получающих тиоридазин. Вещества фенотиазинового ряда действуют на парасимпатическую нервную систему и могут вызывать сухость во рту, что увеличивает потребление воды. Тиоридазин способен и прямо стимулировать центр жажды.
Диагноз устанавливают обычно по одновременному снижению осмоляльности плазмы и мочи. При нормальной осмоляльности плазмы диагностировать первичную полидипсию можно по сохранению нормальной реакции на дегидратацию или путем сопоставления осмоляльности плазмы и мочи в системе координат. Однако больные могут быть столь гипергидратированными, что достижение постоянства осмоляльности мочи в ежечасных пробах требует иногда не менее 18 ч дегидратации. Определение уровней АВП в плазме или моче практически не помогает отдифференцировать первичную полидипсию от несахарного диабета центрального генеза.
Лечение . Несахарный диабет поддается заместительной гормональной коррекции. Пероральный прием вазопрессина, как и большинства других пептидов, неэффективен. Подкожно можно вводить водный препарат вазопрессина в дозах 5-10 ЕД. Продолжительность действия составляет обычно 3-6 ч. Этот препарат используется в основном как начальное терапевтическое средство у находящихся без сознания больных с остро развившимся несахарным диабетом после травмы головы или нейрохирургических вмешательств. Кратковременность его действия позволяет не пропустить момент восстановления функции нейрогипофиза и тем самым предупредить развитие водной интоксикации у больных, получающих внутривенные вливания жидкости.
Десмопрессин обладает более длительной антидиуретической активностью и почти полностью лишен прессорной активности. При интраназальном применении в дозе 10-20 мкг (0,1-0,2 мл) или подкожной инъекции (1 -4 мкг) его антидиуретический эффект у большинства больных продолжается 12-24 ч. Препарат является средством выбора при лечении большинства больных несахарным диабетом. Липрессин представляет собой аэрозоль для орошения носа, одна аппликация которого может вызывать антидиурез в течение примерно 4-6 ч. Всасывание обоих препаратов со слизистой оболочки носа при инфекции верхних дыхательных путей или аллергическом рините с отеком уменьшается. В таких случаях, а также у больных, находящихся в бессознательном состоянии, десмопрессин следует вводить подкожно.
В прошлом больных несахарным диабетом лечили, как правило, внутримышечными инъекциями танната вазопрессина в масле (2,5 или 5 ЕД), антидиуретический эффект которого сохраняется в течение 24-72 ч. Так как этот препарат представляет собой суспензию танната вазопрессина в арахисовом масле, важно согреть ампулу, а затем несколько раз встряхнуть или перевернуть, чтобы коричневый осадок гипофизарного порошка в ампуле распределился равномерно, образуя слегка мутноватую масляную суспензию. Следует пользоваться сухим шприцем.
Больные несахарным диабетом, у которых сохранилась некоторая остаточная секреция АВП (типы 2-4), реагируют на пероральный прием ряда негормональных средств. Хлорпропамид стимулирует секрецию АВП нейрогипофизом и потенцирует эффект субмаксимальных количеств АВП на почечные канальцы. Для возникновения антидиуретической реакции обычно достаточно принимать 200-500 мг препарата 1 раз в сутки. Его действие начинается уже в первые несколько часов после приема и продолжается, как правило, 24 ч. Хлорпропамид может также восстанавливать чувство жажды, и поэтому показан больным с нарушениями центра жажды. Его применение может обсуловливать гипогликемию, но она обычно не возникает при соблюдении регулярного режима питания. Стимулировать секрецию АВП способен и клофибрат, также применяемый для лечения больных несахарным диабетом. Препарат принимают по 500 мг 4 раза в сутки, что быстро обеспечивает стойкий антидиурез. У некоторых больных комбинированное лечение хлорпропамидом и клофибратом приводит к полному восстановлению регуляции в одного обмена. Показано, что и карбамазепин вызывает антидиурез у больных несахарным диабетом, стимулируя секрецию АВП. Эффективная доза составляет 400-600 мг в сутки, но это вещество обладает побочными токсическими эффектами и поэтому не нашло широкого применения
Лекарственные средства, применяемые для лечения больных несахарным диабетом
|
Заболевание |
Лекарственная форма |
Доза |
Длительность эффекта, ч |
|
Несахарный диабет центрального генеза |
|||
|
Заместительная гормональная терапия: |
|||
|
Водный раствор вазопрессина |
Ампулы по 10 или 20 ЕД |
5-10 ЕД подкожно |
3-6 |
|
Десмопрессин |
Флаконы по 2,5 мл, 0,1 мг/мл |
10-20 мкг интраназально или 1- 4 мкг подкожно |
12-24 |
|
Липрессин |
5-мл флаконы, 50 ед/мл |
2-4 ЕД интраназально |
4-6 |
|
Вазопрессина таннат в масле |
Ампулы по 5 ЕД |
5 ЕД внутримышечно |
24-72 |
|
Негормональные средства: |
|||
|
Хлорпропамид |
Таблетки по 100 и 200мг |
200-500 мг в сутки |
|
|
Клофибрат |
Капсулы по 500 мг |
500 мг 4 раза в сутки |
|
|
Карбамазепин |
Таблетки по 200 мг |
400-600 мг в сутки |
|
|
Нефрогенный несахарный диабет |
|||
|
Гидрохлортиазид |
Таблетки по 50 мг |
50-100 мг в сутки |
|
|
Хлорталндон |
Таблетки по 50 мг |
50 мг в сутки |
Перечисленные средства эффективны только при несахарном диабете центрального генеза. У мужчин с нефрогенным несахарным диабетом единственными клинически значимыми средствами лечения являются тиазиды и другие диуретики. Вызывая потерю натрия, диуретики снижают скорость клубочковой фильтрации, усиливают реабсорбцию жидкости в проксимальном отделе нефрона, увеличивают поступление натрия в восходящее колено петли Генле и тем самым снижают способность разводить мочу. Терапевтический эффект диуретиков у больных нефрогенным несахарным диабетом проявляется лишь при условии ограничения потребления соли. Наблюдались две женщины с врожденным нефрогенным несахарным диабетом, у которых существенный лечебный эффект оказывали высокие дозы десмопрессина.
Прогноз. Долговременный прогноз у больного несахарным диабетом зависит главным образом от основной причины заболевания. В отсутствие опухоли мозга или системного заболевания свободный доступ к воде и правильное лечение по поводу полиурии обычно обеспечивают нормальную жизнь и не укорачивают ее ожидаемую продолжительность. Раннее распознавание и лечение важно для профилактики растяжения мочевого пузыря и мочеточников, а также гидронефроза, которые могут возникать у больных с длительной полиурией, особенно при нефрогенном несахарном диабете. В редких случаях при наличии у больного несахарным диабетом адипсии или гиподипсии возникает опасность развития тяжелой дегидратации, которая может привести к сосудистому коллапсу или нарушениям центральной нервной системы. Тяжелые осложнения могут возникать и у больных несахарным диабетом, находящихся в бессознательном состоянии. Поэтому все больные несахарным диабетом должны иметь при себе специальную карточку с указанием своей болезни и потребности в лекарственных средствах и введении жидкости.
T.P. Harrison. Principles of internal medicine. Перевод д.м.н. А. В. Сучкова, к.м.н. Н. Н. Заваденко, к.м.н. Д. Г. Катковского